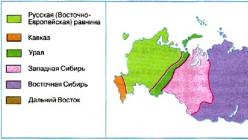
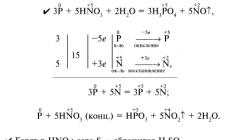9 КЛАСС
Продолжение. См. № 34, 35, 36, 37, 38/2003
Практическая работа № 13.
Азотная кислота. Нитраты
(окончание)
HNО 3 – сильный окислитель . Концентрированная азотная кислота окисляет неметаллы до высших степеней окисления:

Пассивация происходит из-за образования нерастворимых пленок оксидов металлов:
2Al + 6HNO 3 = Al 2 O 3 + 6NO 2 + 3H 2 O.
HNO 3 (конц.) можно хранить и перевозить без
доступа воздуха в емкостях из Fe, Al, Ni.
Качественная реакция – взаимодействие HNO 3
с Сu с образованием газа NO 2 бурого цвета с
резким запахом (кроме того, образуются соль и
вода).

По мере уменьшения концентрации (разбавления) HNO 3 с Zn может образовать разные азотсодержащие продукты:

а также во всех случаях соль и воду.
Примечание
. Для распознавания
нитрат-аниона используется дифениламиновый
индикатор (раствор (C 6 H 5) 2 NH в конц.
H 2 SO 4).
Демонстрационный опыт
.
Распознавание ведется «на следы» или капельным
контактом: появляется темно-синее окрашивание.
Нитраты
– соли азотной кислоты,
твердые кристаллические вещества, хорошо
растворимы в воде. Нитраты щелочных металлов,
кальция и аммония – селитры
.
Большинство нитратов – очень хорошие
минеральные удобрения.
Нитраты – сильные окислители! Уголь, сера и
другие горючие вещества горят в расплавленной
селитре, т. к. все нитраты (как и НNO 3) при
нагревании выделяют кислород и в зависимости от
химической активности металла соли дают разные
продукты:


| Порядок работы | Задания | Наблюдения и выводы |
|---|---|---|
| Собрать прибор (по схеме),
положить в чашечку немного кристаллической
натриевой (чилийской) селитры, расплавить ее.
Раскалить в пламени спиртовки кусочек
древесного угля и спустить его в расплавленную
селитру
|
Почему вспыхивает уголь? Написать уравнения происходящих реакцийна основе электронного баланса, сделать соответствующие выводы | |
| Взять пробы всех трех растворов в пробирках № 1–3 (cм. № 38/2003) и в каждую пробу сначала прилить примерно равное количество (объем) концентрированной серной кислоты, затем добавить понемногу медных стружек, немного подогреть. Наблюдать характерные изменения в одной из проб | В трех пронумерованных пробирках даны растворы хлорида, сульфата и нитрата натрия. Распознать раствор селитры. Почему к раствору нитрата сначала добавляют концентрированную серную кислоту? Написать молекулярное и ионные уравнения реакции. Проверить вывод реакцией «на следы» с дифениламиновым индикатором |
Сложные вещества (скипидар, древесина,
опилки) тоже могут гореть в азотной кислоте.
Смесь концентрированных азотной и серной кислот
(нитрующая смесь) со многими органическими
веществами образует нитросоединения (реакция
нитрования).
Смесь 1 объема HNO 3 (конц.) и 3 объемов HCl (конц.)
называют «царской водкой». В такой смеси
растворяются даже золото Au и платина Pt:

| Порядок работы | Задания | Наблюдения и выводы |
|---|---|---|
| В пробирку с концентрированной азотной кислотой (1 мл) добавить немного медных стружек (Сu). При замедленном эффекте немного подогреть.Работать под тягой! Продукты из санитарной склянки вылить в канализационную систему и смыть струей воды | Чем объясняется выделение бурого газа с резким запахом? Учитывая, что при этом еще образуются вода и нитрат меди(II), написать уравнение реакции. Составить схему электронного баланса и написать уравнение реакции в ионной форме | |
| Порошок мелкокристаллической серы (S) смешать с 1 мл концентрированной HNO 3 , подогреть смесь (под тягой). Взять пробу продуктов реакции и испытать ее 2–3 каплями раствора хлорида бария. Продукты из санитарной склянки немедленно вылить в канализационную систему | Чем объясняются наблюдаемые изменения – растворение серы, выделение бурого резко пахнущего газа (и воды)? Написать уравнение данной реакции. Составить схему электронного баланса и иoннoе уравнение реакции. Что доказывают изменения, наблюдаемые при взаимодействии пробы продуктов реакции с раствором хлорида бария? Ответ обосновать |
Практическая работа 14.
Определение ортофосфатов
Цели
. Научиться распознавать
ортофосфаты, гидроортофосфаты и
дигидроортофосфаты по их растворимости в воде,
гидролизу, качественной реакции на
ортофосфат-анион.
Оборудование и реактивы
. Штатив с
пробирками, cтеклянные трубочки с резиновыми
кольцами, санитарная склянка, шпатели (3 шт.);
кристаллические Са 3 (РO 4) 2 , СаHPO 4 ,
Са(H 2 РO 4) 2 , дистиллированная вода,
универсальный индикатор, pастворы H 3 РO 4 ,
NaCH 3 COO ( = 10%),
AgNO 3 .
| Порядок работы | Задания | Наблюдения и выводы |
|---|---|---|
| В три пробирки насыпать по 1 см 3 ортофосфата, гидроортофосфата и дигидроортофосфата кальция, прилить немного (одинаковое количество) воды, перемешать | Сделать вывод о растворимости первичных, вторичных и третичных ортофосфатов. Можно ли разную растворимость этих фосфатов считать методом их распознавания? | … |
| Используя водные растворы и суспензиив трех пробирках предыдущего опыта, испытать их универсальным индикатором | Определить по шкале pH всех растворов и объяснить, почему pH в этом случае имеет различные значения | … |
| K водному раствору
ортофосфорной кислоты в одной пробирке (1 мл) и раствору суперфосфата в другой (1 мл) добавить 10%-й раствор ацетата натрия и несколько капель нитрата серебра(I) |
Что является реактивомна ион ? Написать уравнения соответствующих реакций в молекулярнойи ионной формах, указать признаки реакций | … |
Практическая работа 15.
Определение минеральных удобрений.
Решение экспериментальных задач по теме
«Подгруппа азота»
Цели
. Повторить состав и свойства
соединений азота и фосфора, их взаимопревращения
и способы распознавания.
Оборудование и реактивы
. Спиртовка,
спички, синее стекло, фильтровальная бумага,
держатель для пробирок, штатив с пробирками (2
шт.), шпатели (3 шт.), ступка, пестик, санитарная
склянка;
в пробирках № 1–3:
I вариант
– суперфосфат двойной, NH 4 NO 3 ,
(NH 4) 2 SO 4 ,
II вариант
– NH 4 Сl, NaNO 3 , KCl,
III вариант
– KNO 3 , (NH 4) 2 SO 4 ,
суперфосфат двойной;
кристаллические соли (NH 4) 2 SO 4 ,
NH4Сl, аммофос, водные растворы СН 3 СOONa ( = 10%), AgNO 3 , BaCl 2 ,
СН 3 СOOH ( = 10%),
NaOH, лакмусовая бумажка, CuO, Cu (стружки), HNO 3
(разб.), HNO 3 (конц.), H 2 SO 4 (конц.),
дифениловый индикатор, (C 6 H 5) 2 NH в
концентрированной H 2 SO 4 ,
Ca(OH) 2 (сухой), вода дистиллированная, AgNO 3
в HNO 3 , в пробирках № 4–6 сухие
кристаллические вещества: Na 2 SO 4 , NH 4 Cl,
NaNO 3 , в пробирках № 7 и 8: H 3 PO 4 и H 2 SO 4
(разб. р-ры), в пробирках № 9 и 10: Na 3 PO 4
и Ca 3 (PO 4) 2 .
Экспериментальная задача . В четырех пронумерованных склянках находятся водные растворы ортофосфата натрия, сульфата аммония, натриевой селитры, хлорида калия. Используя наиболее рациональные методы распознавания (см. табл.), определить, где находится каждое вещество.
Характерные признаки некоторых солей
(методы распознавания)
Таблица
| Название вещества | Внешний вид | Растворимость (в воде) | Взаимодействие раствора данной соли с | Окрашивание пламени | |||
|---|---|---|---|---|---|---|---|
| H 2 SO 4
(конц.) и Cu |
растворами BaСl 2 и СН 3 СООН | раствором NaOH при нагревании | раствором AgNO 3 | ||||
| Нитрат аммония NH 4 NO 3 | Хорошая | NO 2 , бурый, с резким запахом | – | NH 3 , бесцветный, с резким запахом | – | Желтое (от примесей) |
|
| Хлорид аммония NH 4 Cl | Белый кристаллический порошок | Хорошая | – | – | NH 3 | AgCl, белый осадок | Желтое (от примесей) |
| Нитрат калия KNO 3 | Светло-серые мелкие кристаллы | Хорошая | NO 2 | – | – | – | Фиолетовое |
| Cульфат аммония (NH 4) 2 SO 4 | Бесцветные крупные кристаллы | Хорошая | – | BaSO 4 , белый, нерастворим в СН 3 СООН | NH 3 | Ag 2 SO 4 , белый, хорошо растворимый в кислотах | – |
| Суперфосфат Са(H 2 PO 4) 2 2H 2 O | Светло-серый порошок или гранулы | Растворяется медленно | – | Ba 3 (РO 4) 2 , белый, частично растворим в СН 3 СООН |
– | Ag 3 PO 4 , желтый (в присутствии СН 3 СООNa) | Kирпично- красное |
| Сильвинит KCl NaCl | Розовые кристаллы | Хорошая | – | – | AgCl | Желтое с проблесками фиолетового | |
| Хлорид калия KCl | Бесцветные кристаллы | Хорошая | – | – | – | AgCl | Фиолетовое |
Решение

Все ионы в водной среде бесцветные
, по
цвету их распознать невозможно.
2) Поскольку ни одно из веществ (склянки № 1–4) не
отличается худшей растворимостью, то и по этому
признаку растворы не отличить, все – прозрачные
растворы.
3) В двух растворах присутствуют одинаковые
катионы, но во всех – различные анионы, поэтому
качественное распознавание следует вести по
анионам. Реактив на – AgNO 3 в присутствии 10%-го
раствора СН 3 СООNa (или BaCl 2 и СН 3 СООН);
реактив на
– раствор BaCl 2 ; реактив на Cl – –
раствор AgNO 3 в HNO 3 ; реактив на – концентрированная Н 2 SO 4
и Cu (стружки). Можно сразу выявить , затем, используя один реактив
(AgNO 3), распознать все три оставшихся
раствора (или наоборот). Другие варианты более
длительны и требуют значительно большего
расхода реактивов.
4) Все четыре пробы растворов испытать раствором
AgNO 3 (1–2 капли): раствор из склянки № 4
остался без изменения – это должен быть раствор
NaNO 3 ; в склянке № 2 – белый кристаллический
осадок, нерастворимый в кислотах, – это раствор
KCl; две остальные пробы дают мутные растворы, при
добавлении в которые 10%-го раствора СН 3 СООNa
проба № 3 дает осадок желтого цвета – это раствор
Na 3 PO 4 , а проба № 1 – раствор (NH 4) 2 SO 4
(муть исчезает при добавлении кислоты HNO 3).

Проверка первичных испытаний.
К пробе раствора из склянки № 1 добавить по 1–2 капли растворов BaCl 2 и СН 3 СООН, раствор становится молочного цвета, т. к. выпадает белый кристаллический осадок:

Можно эту же пробу проверить добавлением раствора щелочи с нагреванием. Выделяется газ NH 3 , определяемый по характерному запаху и посинению влажной красной лакмусовой бумажки. Уравнение реакции:

К пробе раствора из склянки № 4 добавить концентрированную H 2 SO 4 и Cu (стружки), немного подогреть. Выделяется газ бурого цвета с резким запахом, и раствор становится зеленовато-лазурного цвета:
5) Вывод .
В склянках:
№ 1 – раствор (NH 4) 2 SO 4 ,
№ 2 – раствор KCl,
№ 3 – раствор Na 3 PO 4 ,
№ 4 – раствор NaNO 3 .
Cхема распознавания
Определяемые растворы |
|||
| № 1 | № 2 | № 3 | № 4 |
| (NH 4) 2 SO 4 | KCl | Na 3 PO 4 | NaNO 3 |
| Все растворы прозрачные и бесцветные | |||
| +AgNO 3 | |||
| Помутнение раствора
(Ag 2 SO 4 ,
растворим в кислотах) |
Белый творожистый осадок (AgСl | Согласно варианту записать, растворы каких солей даны в пробирках № 1–3. Определить, где находится каждое из указанных веществ. В выводах записать уравнения проведенных реакций в молекулярной и ионной формах. Отметить признаки каждой качественной реакции | … |
| 1) В пробирку с
небольшим количеством CuO (на кончике шпателя)
добавить раствор HNO 3 , взболтать. 2) В пробирку с концентрированной HNO 3 опустить немного медных стружек (если эффект сразу не наблюдается, немного подогреть смесь) |
Используя выданные
реактивы, получить раствор нитрата меди(II) двумя
способами. Отметить признаки реакций и написать
молекулярные и ионные уравнения реакций. Kакая из реакций является окислительно-восстановительной? |
… | |
| В ступке смешать и
растереть смесь Ca(OH) 2 (чуть
увлажненную) с солью аммония, осторожно понюхать. Повторить опыт с другими солями аммония |
Опытным путем
доказать, что сульфат, нитрат и хлорид аммония нельзя смешивать с известью. Дать соответствующие объяснения |
… | |
| Составить план (порядок) распознавания, наиболее рациональный по времени и расходу реактивов | В пробирках № 4–6
определить кристаллические сульфат натрия, хлорид аммония и нитрат натрия. Написать уравнения реакций. Отметить наблюдаемые признаки реакций |
... | |
| Лучше всего испытать
пробы растворов в пробирках № 7 и 8 реактивами BaCl 2
и CH 3 COOH, очень внимательно наблюдая за результатом при взбалтывании реакционной смеси |
Kачественным
распознаванием определить, в какой из пробирок № 7 и 8 находятся растворы серной и ортофосфорной кислот. Написать уравнения реакций |
... | |
| Составить план
распознавания веществ Na 3 PO 4 и Сa 3 (PO 4) 2 в пробирках № 9 и 10 |
Определить
практически в пробирках № 9 и 10 кристаллические ортофосфаты натрия и кальция |
... | |
Определение солей в рамках теории диссоциации. Соли принято делить на три группы: средние, кислые и основные. В средних солях все атомы водорода соответствующей кислоты замещены на атомы металла, в кислых солях они замещены только частично, в основных солях группы ОН соответствующего основания частично замещены на кислотные остатки.
Существуют также некоторые другие типы солей, например двойные соли, в которых содержатся два разных катиона и один анион: СаСО 3 MgCO 3 (доломит), КСl NaCl (сильвинит), KAl(SO 4) 2 (алюмокалиевые квасцы); смешанные соли, в которых содержится один катион и два разных аниона: СаОСl 2 (или Са(ОСl)Сl); комплексные соли, в состав которых входит комплексный ион, состоящий из центрального атома, связанного с несколькими лигандами : K 4 (желтая кровяная соль), K 3 (красная кровяная соль), Na, Cl; гидратные соли (кристаллогидраты), в которых содержатся молекулы кристаллизационной воды: CuSO 4 5H 2 O(медный купорос), Na 2 SO 4 10Н 2 О (глауберова соль).
Название солей образуют из названия аниона, за которым следует название катиона.
Для солей бескислородных кислот к названию неметалла добавляют суффикс ид, например хлорид натрия NaCl, сульфид железа(Н) FeS и др.
При наименовании солей кислородсодержащих кислот к латинскому корню названия элемента добавляют в случае высших степеней окисления окончание — am , в случае низших степеней окисления окончание -ит. В названиях некоторых кислот для обозначения низших степеней окисления неметалла используют приставку гипо-, для солей хлорной и марганцовой кислот используют приставку пер-, например: карбонат кальция СаСО 3 , сульфат железа(III) Fe 2 (SO 4) 3 , сульфит железа(II) FeSO 3 , гипохлорит калия КОСl, хлорит калия КОСl 2 , хлорат калия КОСl 3 , перхлорат калия КОСl 4 , перманганат калия КМnO 4 , дихромат калия К 2 Сг 2 O 7 .
Кислые и основные соли можно рассматривать как продукт неполного превращения кислот и оснований. По международной номенклатуре атом водорода, входящий в состав кислой соли, обозначают приставкой гидро-, группу ОН - приставкой гидрокси, NaHS - гидросульфид натрия, NaHSO 3 - гидросульфит натрия, Mg(OH)Cl - гидроксихлорид магния, Аl(ОН) 2 Сl - дигидроксихлорид алюминия.
В названиях комплексных ионов сначала указывают лиганды, завершают названием металла с указанием соответствующей степени окисления (римскими цифрами в скобках). В названиях комплексных катионов используют русские названия металлов, например: Cl 2 - хлорид тетраамминмеди(П), 2 SO 4 - сульфат диамминсеребра(1). В названиях комплексных анионов используют латинские названия металлов с суффиксом -ат, например: К[Аl(ОН) 4 ] - тетрагидроксиалюминат калия, Na - тетра- гидроксихромат натрия, K 4 - гексацианоферрат(Н) калия.
Названия гидратных солеи (кристаллогридратов ) образуются двумя способами. Можно воспользоваться системой названий комплексных катионов, описанной выше; например, медный купорос SO 4 Н 2 0 (или CuSO 4 5Н 2 O) можно назвать сульфат тетрааквамеди(П). Однако для наиболее известных гидратных солей чаще всего число молекул воды (степень гидратации) указывают численной приставкой к слову «гидрат», например: CuSO 4 5Н 2 O - пентагидрат сульфата меди(И), Na 2 SO 4 10Н 2 О - декагидрат сульфата натрия, СаСl 2 2Н 2 O - дигидрат хлорида кальция.

Растворимость солей
По растворимости в воде соли делятся на растворимые (Р), нерастворимые (Н) и малорастворимые (М). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если таблицы под рукой нет, то можно воспользоваться правилами. Их легко запомнить.
1. Растворимы все соли азотной кислоты - нитраты.
2. Растворимы все соли соляной кислоты - хлориды, кроме AgCl (Н) , PbCl 2 (М) .
3. Растворимы все соли серной кислоты - сульфаты, кроме BaSO 4 (Н) , PbSO 4 (Н) .
4. Растворимы соли натрия и калия.
5. Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме солей Na + и K + .
Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде. В начале XIX в. шведский химик И. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные. Средние, или нормальные, соли - это продукты полного замещения атомов водорода в кислоте на металл.
Например:
Na 2 CO 3 - карбонат натрия;
CuSO 4 - сульфат меди (II) и т. д.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
Na 2 CO 3 = 2Na + + CO 2 —
Кислые соли - это продукты неполного замещения атомов водорода в кислоте на металл. К кислым солям относят, например, питьевую соду NaHCO 3 , которая состоит из катиона металла Na + и кислотного однозарядного остатка HCO 3 — . Для кислой кальциевой соли формула записывается так: Ca(HCO 3) 2. Названия этих солей складываются из названий средних солей с прибавлением приставки гидро- , например:
Mg(HSO 4) 2 - гидросульфат магния.
Диссоциируют кислые соли следующим образом:
NaHCO 3 = Na + + HCO 3 —
Mg(HSO 4) 2 = Mg 2+ + 2HSO 4 —
Основные соли - это продукты неполного замещения гидроксогрупп в основании на кислотный остаток. Например, к таким солям относится знаменитый малахит (CuOH) 2 CO 3 , о котором вы читали в произведениях П. Бажова. Он состоит из двух основных катионов CuOH + и двухзарядного аниона кислотного остатка CO 3 2- . Катион CuOH + имеет заряд +1, поэтому в молекуле два таких катиона и один двухзарядный анион CO 3 2- объединены в электронейтральную соль.
Названия таких солей будут такими же, как и у нормальных солей, но с прибавлением приставки гидроксо- , (CuOH) 2 CO 3 - гидроксокарбонат меди (II) или AlOHCl 2 - гидроксохлорид алюминия. Большинство основных солей нерастворимы или малорастворимы.
Последние диссоциируют так:
AlOHCl 2 = AlOH 2 + + 2Cl —

Свойства солей


Первые две реакции обмена были подробно рассмотрены ранее.
Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием осадка, например:

Четвертая реакция солей связана с положением металла в электрохимическом ряду напряжений металлов (см. «Электрохимический ряд напряжений металлов»). Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это соблюдается при выполнении следующих условий:
1) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
2) металлы не должны взаимодействовать с водой, поэтому металлы главных подгрупп I и II групп (для последней начиная с Са) не вытесняют другие металлы из растворов солей.


Способы получения солей
Способы получения и химические свойства солей. Соли могут быть получены из неорганических соединений практически любого класса. Наряду с этими способами соли бескислородных кислот могут быть получены при непосредственном взаимодействии металла и неметалла (Cl, S ит. д.).
Многие соли устойчивы при нагревании. Однако соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются.
СаСO 3 = СаО + СO 2
2Ag 2 CO 3 = 4Ag + 2СO 2 + O 2
NH 4 Cl = NH 3 + НСl
2KNO 3 = 2KNO 2 + O 2
2FeSO 4 = Fe 2 O 3 + SO 2 + SO 3
4FeSO 4 = 2Fe 2 O 3 + 4SO 2 + O 2
2Cu(NO 3) 2 = 2CuO + 4NO 2 + O 2
2AgNO 3 = 2Ag + 2NO 2 + O 2
NH 4 NO 3 = N 2 O + 2H 2 O
(NH 4) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 4H 2 O
2КСlO 3 =MnO 2 = 2KCl + 3O 2
4KClO 3 = 3КСlO 4 + KCl
Азотистая кислота существует либо в растворе, либо в газовой фазе. Она неустойчива и при нагревании распадается в парах:
2HNO 2 «NO+NO 2 +Н 2 О
Водные растворы этой кислоты при нагревании разлагаются:
3HNO 2 «HNO 3 +H 2 O+2NO
Эта реакция обратимая, поэтому, хотя растворение NO 2 и сопровождается образованием двух кислот: 2NO 2 + Н 2 O=HNO 2 +HNO 3
практически взаимодействием NO 2 с водой получают HNO 3:
3NO 2 +H 2 O=2HNO 3 +NO
По кислотным свойствам азотистая кислота лишь немного сильнее уксусной. Соли ее называются нитритами и в отличие от самой кислоты являются устойчивыми. Из растворов ее солей можно добавлением серной кислоты получить раствор HNO 2:
Ba(NO 2) 2 +H 2 SO 4 =2HNO 2 +BaSO 4 ¯
На основе данных о ее соединениях предполагают два типа структуры азотистой кислоты:
которым соответствуют нитриты и нитросоединения. Нитриты активных металлов имеют структуру I типа, а малоактивных металлов - II типа. Почти все соли этой кислоты хорошо растворимы, но нитрит серебра труднее всех. Все соли азотистой кислоты ядовиты. Для химической технологии важны KNO 2 и NaNO 2 , которые необходимы для производства органических красителей. Обе соли получают из оксидов азота:
NO+NO 2 +NaOH=2NaNO 2 +Н 2 О или при нагревании их нитратов:
KNO 3 +Pb=KNO 2 +PbO
Pb необходим для связывания выделяющегося кислорода.
Из химических свойств HNO 2 сильнее выражены окислительные, при этом сама она восстанавливается до NO:

Однако можно привести много примеров таких реакций, где азотистая кислота проявляет восстановительные свойства:

Определить присутствие азотистой кислоты и ее солей в растворе можно, если прибавить раствор иодида калия и крахмала. Нитрит-ион окисляет анион иода. Эта реакция требует присутствия Н + , т.е. протекает в кислой среде.
Азотная кислота
В лабораторных условиях азотную кислоту можно получить действием концентрированной серной кислоты на нитраты:
NaNO 3 +H 2 SO 4(к) =NaHSO 4 +HNO 3 Реакция протекает при слабом нагревании.
Получение азотной кислоты в промышленных масштабах осуществляется каталитическим окислением аммиака кислородом воздуха:
1. Вначале смесь аммиака с воздухом пропускают над платиновым катализатором при 800°С. Аммиак окисляется до оксида азота (II):
4NH 3 + 5O 2 =4NO+6Н 2 О
2 . При охлаждении происходит дальнейшее окисление NO до NO 2: 2NO+O 2 =2NO 2
3. Образующийся оксид азота (IV) растворяется в воде в присутствии избытка О 2 с образованием HNO 3: 4NO 2 +2Н 2 O+O 2 =4HNO 3
Исходные продукты - аммиак и воздух - тщательно очищают от вредных примесей, отравляющих катализатор (сероводород, пыль, масла и т.п.).
Образующаяся кислота является разбавленной (40-60% -ной). Концентрированную азотную кислоту (96-98% -ную) получают перегонкой разбавленной кислоты в смеси с концентрированной серной кислотой. При этом испаряется только азотная кислота.
Физические свойства
Азотная кислота - бесцветная жидкость, с едким запахом. Очень гигроскопична, «дымит» на воздухе, т.к. ее пары с влагой воздуха образуют капли тумана. Смешивается с водой в любых соотношениях. При -41,6°С переходит в кристаллическое состояние. Кипит при 82,6°С.
В HNO 3 валентность азота равна 4, степень окисления +5. Структурную формулу азотной кислоты изображают так:
Оба атома кислорода, связанные только с азотом, равноценны: они находятся на одинаковом расстоянии от атома азота и несут каждый по половинному заряду электрона, т.е. четвертая часть азота разделена поровну между двумя атомами кислорода.
Электронную структуру азотной кислоты можно вывести так:
1. Атом водорода связывается с атомом кислорода ковалентной связью:
2. За счет неспаренного электрона атом кислорода образует ковалентную связь с атомом азота:
3. Два неспаренных электрона атома азота образуют ковалентную связь со вторым атомом кислорода:
4. Третий атом кислорода, возбуждаясь, образует свободную 2р- орбиталь путем спаривания электронов. Взаимодействие неподеленной пары азота со свободной орбиталью третьего атома кислорода приводит к образованию молекулы азотной кислоты:
Химические свойства
1. Разбавленная азотная кислота проявляет все свойства кислот. Она относится к сильным кислотам. В водных растворах диссоциирует:
HNO 3 «Н + +NO - 3 Под действием теплоты и на свету частично разлагается:
4HNO 3 =4NO 2 +2Н 2 O+O 2 Поэтому хранят ее в прохладном и темном месте.
2. Для азотной кислоты характерны исключительно окислительные свойства. Важнейшим химическим свойством является взаимодействие почти со всеми металлами. Водород при этом никогда не выделяется. Восстановление азотной кислоты зависит от ее концентрации и природы восстановителя. Степень окисления азота в продуктах восстановления находится в интервале от +4 до -3:
HN +5 O 3 ®N +4 O 2 ®HN +3 O 2 ®N +2 O®N +1 2 O®N 0 2 ®N -3 H 4 NO 3
Продукты восстановления при взаимодействии азотной кислоты разной концентрации с металлами разной активности приведены ниже в схеме.

Концентрированная азотная кислота при обычной температуре не взаимодействует с алюминием, хромом, железом. Она переводит их в пассивное состояние. На поверхности образуется пленка оксидов, которая непроницаема для концентрированной кислоты.

3. Азотная кислота не реагирует с Pt, Rh, Ir, Та, Au. Платина и золото растворяются в «царской водке» - смеси 3 объемов концентрированной соляной кислоты и 1 объема концентрированной азотной кислоты:
Au+НNO 3 +3НСl= AuСl 3 +NO+2Н 2 О НСl+AuСl 3 =H
3Pt+4HNO 3 +12НСl=3PtCl 4 +4NO+8H 2 O 2HCl+PtCl 4 =H 2
Действие «царской водки» заключается в том, что азотная кислота окисляет соляную до свободного хлора:
HNO 3 +HCl=Сl 2 +2Н 2 О+NOCl 2NOCl=2NO+Сl 2 Выделяющийся хлор соединяется с металлами.
4. Неметаллы окисляются азотной кислотой до соответствующих кислот, а она в зависимости от концентрации восстанавливается до NO или NO 2:
S+бНNO 3(конц) =H 2 SO 4 +6NO 2 +2Н 2 ОР+5НNO 3(конц) =Н 3 РO 4 +5NO 2 +Н 2 О I 2 +10HNO 3(конц) =2HIO 3 +10NO 2 +4Н 2 О 3Р+5HNO 3(p азб) +2Н 2 О= 3Н 3 РО 4 +5NO
5. Она также взаимодействует с органическими соединениями.
Соли азотной кислоты называются нитратами, представляют собой кристаллические вещества, хорошо растворимые в воде. Их получают при действии HNO 3 на металлы, их оксиды и гидроксиды. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры используются главным образом как минеральные азотные удобрения. Кроме того, KNO 3 применяют для приготовления черного пороха (смесь 75% KNO 3 , 15% С и 10% S). Из NH 4 NO 3 , порошка алюминия и тринитротолуола изготавливают взрывчатое вещество аммонал.
Соли азотной кислоты при нагревании разлагаются, причем продукты разложения зависят от положения солеобразующего металла в ряду стандартных электродных потенциалов:

Разложение при нагревании (термолиз) - важное свойство солей азотной кислоты.
2KNO 3 =2KNO 2 +O 2
2Cu(NO 3) 2 =2CuO+NO 2 +O 2
Соли металлов, расположенных в ряду левее Mg, образуют нитриты и кислород, от Mg до Cu - оксид металла, NO 2 и кислород, после Си - свободный металл, NO 2 и кислород.
Применение
Азотная кислота - важнейший продукт химической промышленности. Большие количества расходуются на приготовление азотных удобрений, взрывчатых веществ, красителей, пластмасс, искусственных волокон и др. материалов. Дымящая
азотная кислота применяется в ракетной технике в качестве окислителя ракетного топлива.
Со степенями окисления +1, +2, +3, +4, +5.
Оксиды N20 и N0 несолеобразующие (что это означает?), а остальные оксиды - кислотные: N2O3 соответствует азотистая кислота НN02, а N205 - азотная кислота НNO3. Оксид азота(IV) N02, при растворении в воде образует одновременно две кислоты - HNO2 и НNO3.
Если же он растворяется в воде в присутствии избытка кислорода, получается только азотная кислота
4N02 + 02 + 2Н20 = 4НNO3
Оксид азота(IV) NO2 - бурый, очень ядовитый газ. Он легко получается при окислении кислородом воздуха бесцветного несолеобразующего оксида азота(П):
Содержание урока конспект урока опорный каркас презентация урока акселеративные методы интерактивные технологии Практика задачи и упражнения самопроверка практикумы, тренинги, кейсы, квесты домашние задания дискуссионные вопросы риторические вопросы от учеников Иллюстрации аудио-, видеоклипы и мультимедиа фотографии, картинки графики, таблицы, схемы юмор, анекдоты, приколы, комиксы притчи, поговорки, кроссворды, цитаты Дополнения рефераты статьи фишки для любознательных шпаргалки учебники основные и дополнительные словарь терминов прочие Совершенствование учебников и уроков исправление ошибок в учебнике обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми Только для учителей идеальные уроки календарный план на год методические рекомендации программы обсуждения Интегрированные урокиДля того, чтобы изобразить формулу соли графически, следует:
1. Правильно написать эмпирическую формулу этого соединения.
2. Учитывая, что любая соль может быть представлена как продукт нейтрализации соответствующих кислоты и основания, следует изобразить отдельно формулы кислоты и основания, которые образуют данную соль.
Например:
Ca(HSO 4) 2 – гидросульфат кальция можно получить при неполной нейтрализации серной кислоты H 2 SO 4 гидроксидом кальция Са(ОН) 2 .
3. Определить, какое количество молекул кислоты и основания требуется для получения молекулы этой соли.
Например:
Для получения молекулы Ca(HSO 4) 2 требуется одна молекула основания (один атом кальция) и две молекулы кислоты (два кислотных остатка НSО 4 1).
Са(ОН) 2 + 2H 2 SO 4 = Ca(HSO 4) 2 + 2H 2 O.
Далее следует построить графические изображения формул установленного числа молекул основания и кислоты и, мысленно убрав участвующие в реакции нейтрализации и образующие воду анионы гидроксила основания и катионы водорода кислоты, получить графическое изображение формулы соли:
O – H H - O O O O
Сa + → Ca
+ 2 H - O - H
+ → Ca
+ 2 H - O - H
O – H H - O O O O
H- O O H - O O
Физические свойства солей
Соли представляют собой твердые кристаллические вещества. По растворимости в воде их можно подразделить на:
1) хорошо растворимые,
2) мало растворимые,
3) практически нерастворимые.
Большинство солей азотной и уксусной кислот, а также солей калия, натрия и аммония – растворимы в воде.
Соли имеют широкий диапазон температур плавления и термического разложения.
Химические свойства солей
Химические свойства солей характеризуют их отношение к металлам, щелочам, кислотам и солям.
1. Соли в растворах взаимодействуют с более активными металлами.
Более активный металл замещает менее активный металл в соли (см. табл.9 приложения).
Например:
Рb(NO 3) 2 + Zn = Рb + Zn(NO 3) 2,
Hg(NO 3) 2 + Cu = Нg + Cu(NO 3) 2 .
2. Растворы солей взаимодействуют со щелочами , при этом получаются новое основание и новая соль.
Например:
CuSO 4 + 2КОН = Сu(ОН) 2 + 2K 2 SO 4 ,
FeCl 3 +3NаОН = Fe(OH) 3 + 3NaCl.
3. Соли реагируют с растворами более сильных или менее летучих кислот, при этом получаются новая соль и новая кислота.
Например:
а) в результате реакции образуется более слабая кислота или более летучая кислота:
Na 2 S + 2НС1 = 2NaCl + H 2 S
б) возможны и реакции солей сильных кислот с более слабыми кислотами, если в результате реакции образуется малорастворимая соль:
СuSО 4 + Н 2 S = СuS + H 2 SO 4 .
4. Соли в растворах вступают в обменные реакции с другими солями , при этом получаются две новые соли.
Например:
NaС1 + АgNO 3 = AgCl + NaNO 3 ,
CaCI 2 + Na 2 CO 3 = CaCO 3 + 2NaCl,
CuSO 4 + Na 2 S = CuS+ Na 2 SO 4 .
Следует помнить, что обменные реакции протекают практически до конца, если один из продуктов реакции выделяется из сферы реакции в виде осадка, газа или если при реакции образуется вода или другой слабый электролит.